藥物安全性評估 Preclinical Testing Service
藥物安全性評估
新藥首次進行臨床試驗前及獲得核准上市前,都必須經過一系列的臨床前毒性試驗,以提供新藥的安全性訊息,雖然全球的監管機構都會要求毒性測試,但進行臨床前試驗的具體標準因區域而異,而在藥物市場三個最大地區(美國,歐洲和日本)的共同努力下,透過國際協合會議( International Conference for Harmonization,ICH)發佈了指引綱要,統一了監管機構期望的臨床前試驗,當新藥開發到進入臨床試驗,會進行從non-GLP到GLP試驗,而謹慎的臨床前試驗規劃,可以提供足夠的新藥安全評估及首次人類用藥( First in human,FIH )的使用劑量。
- 服務項目
- 藥品快訊
- 下載專區
服務項目
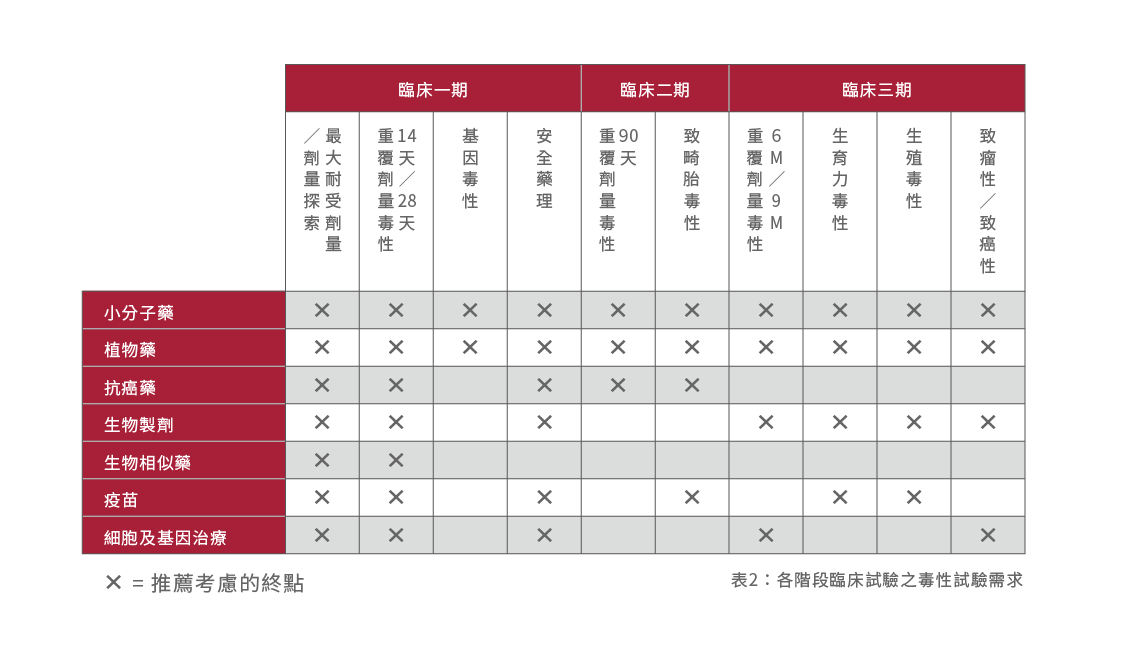
幸運的是ICH除了為臨床一期試驗的安全性評估提供建議外,還提供非臨床試驗不同類型毒性(例如生殖及發育毒性、致癌性)及長期的毒性試驗的指引(表2),以支持新藥產品的上市審批。
進階生技的專業團隊已協助新藥開發商完成超過30個以上新藥安全評價案件,目前已分別在台灣、歐洲、美國等地進行臨床試驗。
藥物/毒物動力
- 藥物/毒物動力學試驗(PK/TK)
- 細胞分佈試驗(Bio-D)
一般毒理
- 單一劑量
- 最大耐受性試驗(MTD)
- 延伸性毒性試驗
- 重覆劑量
- 7天/14天劑量探索試驗(DRF)
- 14天/28天毒性試驗
- 90天毒性試驗
- 180天毒性試驗
- 39週毒性試驗
- 52週毒性試驗
基因毒理
- 細菌逆突變試驗:篩選試驗
- 染色體變異試驗:篩選試驗
- 細菌逆突變試驗 - Ames Test
- 染色體變異試驗 - CA Test
- 小鼠淋巴瘤試驗 - MLA(TK)Test
- 生體微核試驗(MN)
- 生體Pig-a試驗
安全藥理
- 體外hERG試驗
- 中樞神經功能評估
- 心血管系統評估
- 呼吸功能評估
生殖毒理
- 生殖一期:生育力試驗
- 生殖二期:胚胎發育(致畸胎)試驗
- 生殖三期:週產期前後之幼胎發育試驗
致瘤性
- 體外致瘤性試驗 - Soft agar method
- 生體致瘤性試驗
免疫毒理
- 過敏性試驗 - 天竺鼠極大化試驗 (GPMT)
- 過敏性試驗 - 貼布試驗 (Buchler Test)
- 全身主動過敏試驗 (ASA)
- 被動皮膚過敏試驗 (PCA)
特殊毒理
- 體外眼刺激性試驗
- 體外皮膚刺激 / 腐蝕性試驗
- 體外溶血試驗
- 眼刺激性試驗
- 皮膚刺激性試驗
- 血管刺激性試驗
- 局部耐受性試驗
- 熱源試驗
- 異常毒性試驗
客製化服務
- 異種腫瘤動物模式(Xenograft tumor mode)
- 細胞激素趨勢分析(Cytokine profile analysis)
- 生物標記分析(Biomaker analysis)
- 免疫組織染色(Immunohistochemistry analysis)


藥品快訊